Αρχή λειτουργίας μπαταρίας
Πώς λειτουργεί ένα ρολόι τοίχου, ένα τηλεχειριστήριο τηλεόρασης ή ένα ραδιοελεγχόμενο παιδικό παιχνίδι; Οι περισσότεροι άνθρωποι, χωρίς δισταγμό, θα απαντήσουν "από μπαταρίες" και, καταρχήν, θα έχουν δίκιο. Αλλά είναι απίθανο κανένας από αυτούς να μπορεί να πει πώς ακριβώς τριπλασιάζεται η φορητή μπαταρία, πώς λειτουργεί και χωρίς ποιον θα ήταν αδύνατη η όλη διαδικασία μετάδοσης ηλεκτρικού ρεύματος από την μπαταρία στον τελικό καταναλωτή. Ας καλύψουμε αυτό το ενοχλητικό κενό γνώσης.
Το περιεχόμενο του άρθρου
Αρχή λειτουργίας μπαταρίας
Για να κατανοήσετε την αρχή λειτουργίας μιας συμβατικής μπαταρίας ΑΑ, πρέπει να έχετε μια γενική κατανόηση της δομής της. Έτσι, οποιαδήποτε μπαταρία αποτελείται από τρία κύρια στοιχεία - άνοδο, κάθοδο και ηλεκτρολύτη. Επιπλέον, το τελευταίο μπορεί να έχει σχεδόν οποιαδήποτε κατάσταση συσσωμάτωσης: η κάθοδος και η άνοδος που τοποθετούνται σε αλατούχο διάλυμα, καταρχήν, είναι επίσης μια «μπαταρία», μόνο σε μια μορφή που είναι ασυνήθιστη για τον μέσο άνθρωπο.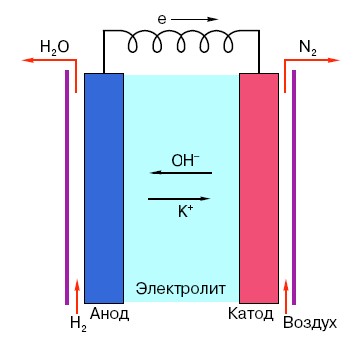
Ενδιαφέρων! Η λεγόμενη «βολταϊκή στήλη», που εφευρέθηκε από τον Alessandro Volta, διέθετε επίσης όλα τα απαραίτητα στοιχεία για την παραγωγή ηλεκτρικού ρεύματος. Αποτελούνταν από πλάκες ψευδαργύρου και χαλκού στοιβαγμένες η μία πάνω στην άλλη, μεταξύ των οποίων τοποθετούνταν ως «στρώμα» ένα πανί εμποτισμένο με οξύ.
Η άνοδος σε τέτοια συστήματα είναι η κύρια πηγή ηλεκτρονίων, τα οποία, όπως γνωρίζουμε από ένα σχολικό μάθημα φυσικής, έχουν αρνητικό φορτίο.Τα αρνητικά φορτισμένα σωματίδια έλκονται από θετικά και σε αυτή την περίπτωση η επιφάνεια της καθόδου λειτουργεί ως «συν».
Αλλά αυτό δεν αρκεί για να εμφανιστεί ένα ηλεκτρικό ρεύμα, επειδή τα ηλεκτρόνια χρειάζονται επίσης ένα είδος «εθνικού δρόμου» - ένα μέσο που θα υποστήριζε την αλληλεπίδραση της καθόδου και της ανόδου. Εδώ εμφανίζεται ένας ηλεκτρολύτης "επί σκηνής" - ένα άλας, ένα αλκάλιο ή ένα οξύ ικανό να μεταφέρει ρεύμα.
Ας δούμε την αρχή της λειτουργίας χρησιμοποιώντας ένα συγκεκριμένο παράδειγμα: υπάρχει μια μπαταρία με ονομαστική τάση 18 βολτ. Η τάση μεταξύ των ηλεκτροδίων σε αυτό είναι σταθερή μέχρι να συνδεθεί στο δίκτυο. Μόλις εμφανιστεί ένας καταναλωτής (για παράδειγμα, ένας συνηθισμένος λαμπτήρας), η τάση αρχίζει να μειώνεται σταδιακά, το ρεύμα αρχίζει να ρέει από το "αρνητικό" ηλεκτρόδιο στο "θετικό" και εμφανίζεται μια χημική αντίδραση στον ηλεκτρολύτη που στοχεύει διατηρώντας τη διαφορά δυναμικού μεταξύ των ηλεκτροδίων.
Αναφορά. Όσο περισσότερη ενέργεια απαιτεί ο καταναλωτής, τόσο πιο έντονη είναι η αντίδραση στο εσωτερικό της μπαταρίας και τόσο πιο γρήγορα θα αποτύχει.
Πώς λειτουργεί μια επαναφορτιζόμενη μπαταρία, πώς διαφέρει από μια κανονική
Έτσι, εξετάσαμε τις κλασικές μπαταρίες "δάχτυλο" και "μικρό δάχτυλο" και γνωρίζουμε ότι η διάρκεια ζωής των περισσότερων από αυτές είναι αυστηρά περιορισμένη (ό,τι κι αν λένε οι διάσημοι κατασκευαστές). Τι γίνεται όμως με τις λεγόμενες μπαταρίες - μπαταρίες τύπου μπαταρίας που μπορούν όχι μόνο να καταναλώνουν ενέργεια κατά τη διαδικασία της αντίδρασης, αλλά και να τη συσσωρεύουν και να την αποθηκεύουν για μεγάλο χρονικό διάστημα;
Για να κατανοήσουμε την αρχή της λειτουργίας της μπαταρίας, είναι απαραίτητο να στραφούμε στη χημεία. Ας πάρουμε ως παράδειγμα... Μια κανονική φωτιά στα κάρβουνα.Ανεξάρτητα από το πόσο όμορφη και συναρπαστική φαίνεται η φλόγα, όποιος χημικός την παρατηρεί γνωρίζει ότι αυτή η διαδικασία είναι απλώς μια μακροχρόνια αντίδραση οξείδωσης του καυσίμου. Η καύση άνθρακα αλληλεπιδρά με το οξυγόνο και ως αποτέλεσμα αυτής της αντίδρασης παίρνουμε:
- διοξείδιο του άνθρακα;
- φως;
- ζεστός.
Και αν τα δύο τελευταία σημεία είναι ικανά να ζεστάνουν ψυχή και σώμα, τότε δεν μπορούμε να χρησιμοποιήσουμε με κανέναν τρόπο το διοξείδιο του άνθρακα, γιατί είναι υποπροϊόν της αντίδρασης, που είναι, στην πραγματικότητα, τα απόβλητά του. Η αντίδραση οξείδωσης σταματά όταν τελειώσουν τα αρχικά στοιχεία: οξυγόνο και άνθρακας. Η διακοπή της αντίδρασης σε μια μπαταρία συμβαίνει ακριβώς με τον ίδιο τρόπο όταν οι αρχικές ουσίες έχουν εξαντληθεί πλήρως και μένουν μόνο «απόβλητα».
Στην μπαταρία όλα γίνονται λίγο διαφορετικά. Το γεγονός είναι ότι η αντίδραση που εμφανίζεται σε αυτό ανήκει στην κατηγορία των αναστρέψιμων, δηλαδή, υπό ορισμένες συνθήκες μπορεί να "αντιστραφεί", επιστρέφοντας όλες τις ουσίες στην αρχική τους κατάσταση. Είναι η πιθανότητα να συμβεί μια αναστρέψιμη αντίδραση στην μπαταρία που επιτρέπει τη φόρτισή της.
Σε μια μπαταρία συνδεδεμένη στο δίκτυο, η αντίδραση προχωρά προς την αντίθετη κατεύθυνση και το ρεύμα ρέει από το "συν" στο "πλην" και όχι το αντίστροφο. Ως αποτέλεσμα, το προϊόν της αντίδρασης σχηματίζει τις αρχικές ουσίες και ο ιδιοκτήτης της μπαταρίας λαμβάνει τη διαθέσιμη «ανακτημένη» ενέργεια σε φορητή μορφή. Αυτό είναι όλο!





